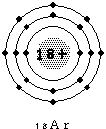
丂
丂丂
丂儁僩儕嶮偺椉抂偵偼傾儖儈僯僂儉敁傪擖傟偰偁傝傑偡丅偙偺傾儖儈僯僂儉敁偵俆侽倁偺揹埑傪偐偗傑偡丅偦偟偰丆儁僩儕嶮偺姦揤偺拞怱偵丆彫偝偄夁儅儞僈儞巁僇儕僂儉俲俵値俷係偺寢徎傪偺偣傑偡丅
丂
 丂
丂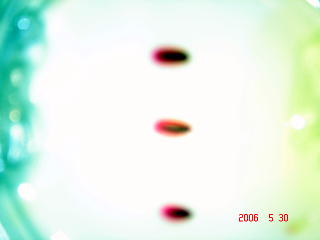
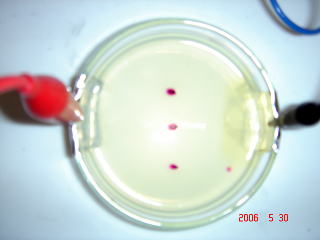
丂愒巼怓偺偟傒偑嵍懁偵堏摦偟偰偄傞偺偑傢偐傝傑偡偹丅嵍懁偼梲嬌偱偡丅梲嬌偵岦偐偭偰堏摦偡傞棻巕偵偼偳偺傛偆側惈幙偑偁傞偺偱偟傚偆偐丅晧偺揹婥傪懷傃偰偄傞偙偲偑傢偐傝傑偡偹丅偙偺愒巼怓偺偟傒偼夁儅儞僈儞巁僀僆儞俵値俷係俀亅偱偡丅
丂僀僆儞偲偄偆偙偲偽傪暦偄偨偙偲偼偁傝傑偡偹丅僀僆儞偼丆儅僀働儖丒僼傽儔僨乕偵傛偭偰柦柤偝傟傑偟偨丅
丂

丂僀僆儞偲偼僊儕僔儍岅偺乽峴偔乿偺堄枴偱偁傞倝倕値倎倝偐傜峫埬偝傟傑偟偨丅傑偨丆梲僀僆儞偺們倎倲倝倧値偲偼倗倧丂倲倧丂們倎倲倛倧倓倕乮堿嬌偵峴偔乯偺堄枴偱偁傝丆堿僀僆儞偺倎値倝倧値偲偼倗倧丂倲倧丂倎値倧倓倕乮梲嬌傊峴偔乯偺堄枴偱偡丅揹応偺拞偵偍偗傞僀僆儞偺摦偒偐傜峫偊偨傛偆偱偡偹丅斵偼惢杮壆偵擭婫曭岞偟偨屻丆墹棫尋媶強偺彆庤偵嵦梡偝傟丆揹帴婥妛傪拞怱偵懡戝側嬈愌傪巆偟偨偺傒側傜偢丆僋儕僗儅僗偵墹棫尋媶強庡嵜偱奐偐傟傞巕偳傕偨偪傊偺壢妛島嵗傪拞怱偵側偭偰悇偟恑傔偨丆嫵堢幰偲偟偰傕執戝側恖偱偡丅偦偺偲偒偺僥乕儅偺侾偮丆儘乕僜僋偺壢妛偼崱傕撉傒宲偑傟丆傑偨墹棫尋媶強偱偼崱擔傕壢妛島嵗偑奐嵜偝傟偰偄傑偡丅
丂丂

丂偲偙傠偱丆僀僆儞倝倧値偲偼揹婥傪懷傃偨棻巕偺偙偲偱偡丅偳偆偟偰揹婥傪懷傃偨棻巕偑埨掕偵懚嵼偡傞偺偱偟傚偆偐丅傑偨丆拞妛峑偺偲偒偵妛傫偩揹婥暘夝傗揹抮偼丆僀僆儞偑娭學偟偰偄傞偺偱偡丅僀僆儞偺峫偊曽傪巊偆偲丆揹婥暘夝傗揹抮偺愢柧偑娙扨偵側傝傑偡丅偑傫偽偭偰曌嫮偟傑偟傚偆丅嬶懱揑側崱擔偺撪梕偼丆
乮侾乯揹婥塲摦
乮俀乯僀僆儞偺揹巕攝抲
乮俁乯僀僆儞偺惗惉偲僄僱儖僊乕
乮係乯尨巕偲僀僆儞偺戝偒偝
偱偡丅
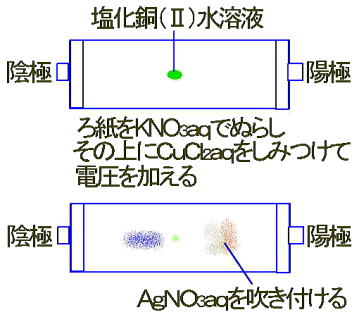
 侾丏墫壔摵乮II)偺壔妛幃傪帵偟側偝偄丅 俠倳俠倢俀 俀丏墫壔摵乮俬俬乯悈梟塼傪揹婥暘夝偡傞偲丆壗偑惗惉偟傑偡偐丠 梲嬌偐傜墫慺偑敪惗偟丆堿嬌偵摵偑晅拝偡傞丅 |
 丂丂丂
丂丂丂 丂丂丂
丂丂丂