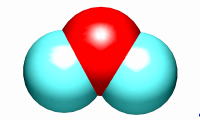
いままでに,物質は原子,分子,イオンなどの粒子からできていることを学びました。この章からは原子,分子,イオンなどの粒子の質量をどのように扱えばよいか考えていきましょう。原子や分子はとても小さい粒子ですから,1個や10個を天秤にのせても質量はわかりませんね。そこで工夫が必要なのです。化学の量関係を考えるには,とても大切なところです。がんばってマスターしてください。
いままでに,物質は原子,分子,イオンなどの粒子からできていることを学びました。この章からは原子,分子,イオンなどの粒子の質量をどのように扱えばよいか考えていきましょう。原子や分子はとても小さい粒子ですから,1個や10個を天秤にのせても質量はわかりませんね。そこで工夫が必要なのです。化学の量関係を考えるには,とても大切なところです。がんばってマスターしてください。この章の学習内容は次の通りです。
(1)原子量
(2)分子量
(3)式量
 1.原子核中の陽子の数を何といいますか? 原子番号 2.炭素元素の原子番号はいくらですか? 6 3.原子核中の陽子と中性子の数の和を何といいますか? 質量数 4.原子番号が同じで,質量数の異なる原子を互いに何といいますか? 同位体(アイソトープ) |

実は,以前は酸素原子を基準にしていました。ところが,物理の世界では質量数16の酸素原子を16としていたのに対して,化学の世界では質量数16,17,18を含む酸素元素を16としていたのです。この違い変わりますか。化学の方がややアバウトな感じがしますが,ある意味では実質的ということもできます。しかし,物理と化学で原子量が微妙に違うというのは不都合なことです。そこで,1961年IUPAC(国際純正応用化学連合原子量委員会)が質量数12の炭素原子を12とする新しい原子量の定義を決めたのです。その理由は,物理と化学の原子量の修正を最も少なくするためであるといわれています。この現在の基準による原子量と以前の化学的原子量の比は0.999957に過ぎません。