物質が燃焼すると,大きな発熱がありますね。燃焼は,熱や光を出しながら激しく物質と酸素が化合する化学反応であり,燃焼しはじめると,発生した熱によって連続的に激しく空気中の酸素と化合して,熱を出し続けます。蒸気機関車は石炭を燃やして得られる熱エネルギーを運動エネルギーに変換しています。
物質が燃焼すると,大きな発熱がありますね。燃焼は,熱や光を出しながら激しく物質と酸素が化合する化学反応であり,燃焼しはじめると,発生した熱によって連続的に激しく空気中の酸素と化合して,熱を出し続けます。蒸気機関車は石炭を燃やして得られる熱エネルギーを運動エネルギーに変換しています。このように物質が変化するときは,必ず熱の出入りがあります。また,物質の状態変化に比べて化学変化のときには,多量の熱が発生したり吸収されたりします。どうして熱の出入りがあるのでしょうか。
この章の学習内容は,次の通りです。
(1) 熱と熱量
(2) 反応熱
(3) 熱化学方程式
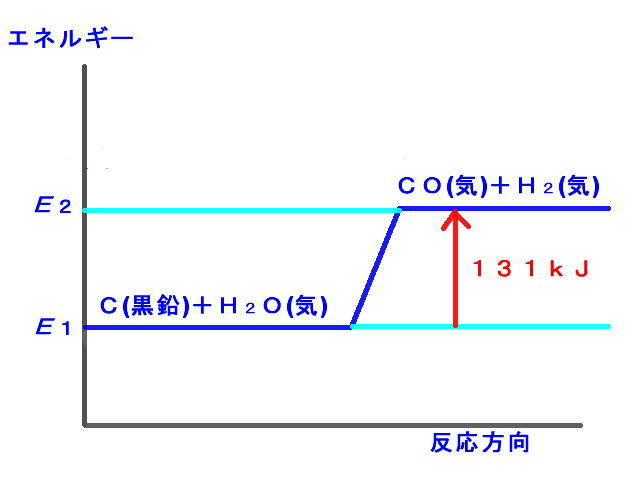
(4) いろいろな反応熱
 1.熱を発生する反応を何といいますか? 発熱反応という。 2.周囲の熱を吸収する反応を何といいますか? 吸熱反応という。 |