この章では,生成熱や結合エネルギーについて学びましょう。この章の内容も,ヘスの法則と関係があります。
この章では,生成熱や結合エネルギーについて学びましょう。この章の内容も,ヘスの法則と関係があります。 1.単体とは何ですか? それ以上細かい成分に分けることのできない純物質のことをいう。 単体は,1種類の元素でできた純物質である。 2.共有結合とは,どのような結合ですか? 原子間で出し合った価電子を共有してできる結びつきのことをいう。 |
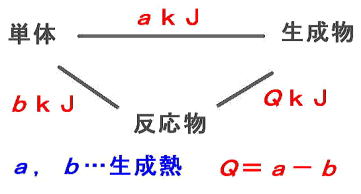
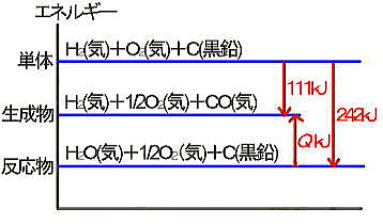
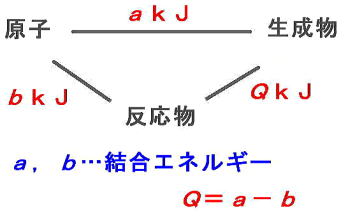
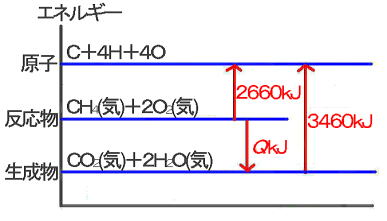
結合エネルギーは,化学 II で扱う内容ですが,ここで紹介しておきます。結合エネルギーは,共有結合を切るために必要なエネルギーです。この結合エネルギーを使っても,反応熱を求めることができます。
この章の学習内容は,次の通りです。
(1)生成熱
(2)結合エネルギー
では,生成熱からはじめましょう。単体の生成熱が0になることに注意してください。