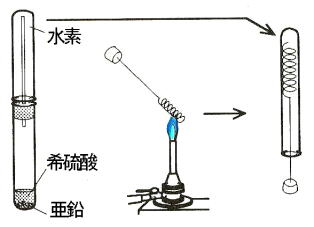
この章では,酸化還元反応について調べる実験を紹介します。その前に,酸化剤と還元剤について復習しておきましょう。
この章では,酸化還元反応について調べる実験を紹介します。その前に,酸化剤と還元剤について復習しておきましょう。 1.酸化剤とは何ですか? 酸化還元反応において,電子を奪い,相手の物質を酸化する物質のことをいう。 2.還元剤とは何ですか? 酸化還元反応において,電子を与え,相手の物質を還元する物質のことをいう。 |
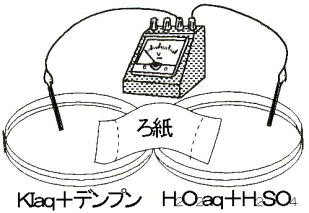
次に,ヨウ化物イオンI−が酸化されてヨウ素分子I2になると,もちろん色の変化があります。しかし,それだけではなく,ヨウ素デンプン反応によってヨウ素分子を確認することができますね。
また,色の変化がなくても,酸化されると気体が発生するものもあります。シュウ酸(COOH)2が酸化されると二酸化炭素CO2が発生します。過酸化水素H2O2が酸化されると酸素O2を発生します。しかし,気体の発生は少量であり,急激なため注意しなければいけません。