この章から無機物質について,勉強します。まず,周期表と元素の性質の関係について復習しましょう。
この章から無機物質について,勉強します。まず,周期表と元素の性質の関係について復習しましょう。 1.典型元素の単体の性質は,何の増加とともに周期的に変化しますか? 原子番号 2.同じ族に属する元素群を何といいますか? 同族元素 |

18族の希ガスは,1年生のときに詳しくやりましたから,17族元素からはじめます。17族元素はハロゲンと総称されていますが,Haloはギリシャ語で「造塩」,genは「素」の意味です。NaClなどの塩をつくる素になっているという意味でしょうか。
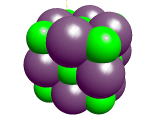
身近なところでは,塩素が水道水の消毒に使われており,ヨウ素はうがい薬(イソジンガーグル)などに使われています。ハロゲン原子の価電子は7個でしたね。したがって,1価の陰イオンになりやすいのです。
この章の学習内容は,次の通りです。
(1)ハロゲン元素
(2)ハロゲンの単体
(3)ハロゲンの化合物
それでは,ハロゲン元素からはじめましょう。主なものは,フッ素F,塩素Cl,臭素Br,ヨウ素Iです。