気体を発生させて水上置換で捕集するとき,捕集した気体の圧力は大気圧に等しいでしょうか。この章では,混合気体の圧力について考えてみましょう。
気体を発生させて水上置換で捕集するとき,捕集した気体の圧力は大気圧に等しいでしょうか。この章では,混合気体の圧力について考えてみましょう。 1.空気の主な成分は何ですか? 窒素と酸素   2.乾燥空気中には,それぞれ体積で何%含まれていますか? 窒素は約78%,酸素は約21% 3.気体の圧力の単位は? 国際単位系(SI)による圧力の単位はPa(パスカル)であり,1Paは面積1m2あたりに1N(ニュートン)の力がはたらくときの圧力を表す。また,100Paを1hPa(ヘクトパスカル)という。 |

この章の学習内容は,次の通りです。
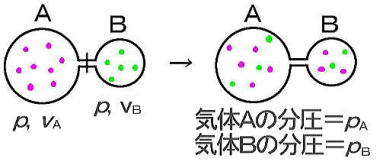
(1)分圧の法則
(2)分圧とモル分率
(3)混合気体の分子量
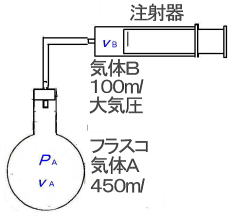
最初に実験を紹介しましょう。この実験では,気体Aと気体Bはともに空気ですが,違う種類の気体と考えてください。