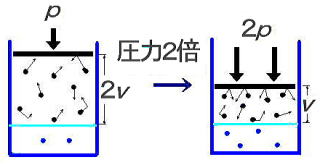
炭酸飲料水の入っている容器の栓を開けると,水溶液からさかんに気泡が発生しますね。もちろんこの気泡は二酸化炭素CO2です。
炭酸飲料水の入っている容器の栓を開けると,水溶液からさかんに気泡が発生しますね。もちろんこの気泡は二酸化炭素CO2です。
では,どうして栓を開けると,二酸化炭素の気泡が発生するのでしょうか。
この章の学習内容は,次の通りです。
(1)気体の溶解度
(2)ヘンリーの法則
(3)二酸化炭素の溶解
 1.溶解度とは何ですか? 水100gに物質を溶かして飽和水溶液にしたとき,溶けた溶質の質量〔g〕の値。(中学校理科) ある温度,ある圧力で,溶質がそれ以上溶けなくなった溶液を飽和溶液といい,その溶液の濃度を溶解度(普通,溶媒100gに溶解する溶質の質量〔g〕で表す)という。(高等学校化学) 2.固体の溶解度は,一般に温度を上げるとどのようになりますか? 溶解度の大きくなるものが多い。 |