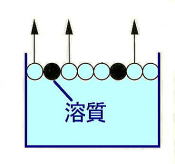
水と砂糖水とでは,水だけの方が早く蒸発するのを知っていますか。また,海水でぬれた水着は,真水でぬれた水着より乾きにくいですね。どうしてでしょう。
水と砂糖水とでは,水だけの方が早く蒸発するのを知っていますか。また,海水でぬれた水着は,真水でぬれた水着より乾きにくいですね。どうしてでしょう。
この章の学習内容は,次の通りです。
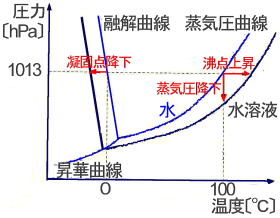
(1)蒸気圧降下
(2)沸点上昇
(3)凝固点降下
(4)電解質の凝固点降下度
 1.蒸気圧とは何ですか? 密閉し容器内に適当量の水を入れて放置すると,その上部の空間に蒸発した水蒸気が,一定温度では一定の圧力を示すようになる。このとき,上部の空間は水蒸気が飽和した状態になっており,このときの圧力を水の飽和蒸気圧(または単に蒸気圧)という。 2.電解質とは何ですか? 水溶液が電気を通す物質をいう。 |