上の可逆反応の例は,アンモニアの製法(ハーバー・ボッシュ法)や酢酸エチルの合成などがありましたね。酢酸エチルはボンドのにおいがしました。 上の可逆反応の例は,アンモニアの製法(ハーバー・ボッシュ法)や酢酸エチルの合成などがありましたね。酢酸エチルはボンドのにおいがしました。
原理的には,反応物と生成物が存在するとき,すべての反応は可逆反応です。しかし,実際には,平衡状態で生成物の割合が著しく大きい反応系の場合,逆反応は非常に小さく,反応が不可逆的に一方向に進むと考えて差し支えがありません。
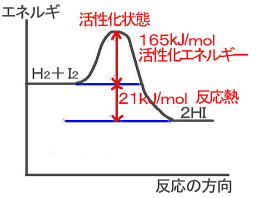
閉じた容器に窒素と水素を入れます。しばらくすると,アンモニアが生成されますね。やがて,容器内の窒素の濃度と水素の濃度とアンモニアの濃度が,それぞれ一定の値をとるようになります。しかし,正反応も逆反応も進行しているのです。すなわち,「正反応の反応速度=逆反応の反応速度」の関係が成立しているのです。
化学平衡において,平衡定数が定義されています。平衡定数は,反応の種類や温度によって変わります。逆の言い方をすれば,種類と温度が一定であるなら,平衡定数は一定ということになります。この平衡定数の説明の前に必要なことがあります。
いま,次の反応を考える。
AがあるBに衝突する回数はAの濃度([A])に比例する。また,BがあるAに衝突する回数はBの濃度([B])に比例する。そこで,反応速度は衝突回数に比例すると仮定すると次の式が成り立つ。
| v=k[A][B] kは速度定数 rate constant |
B=Aのとき,あるAに衝突する別のAは1個減り,(a−1)個になるため,a(a−1)個に比例するが,ここは近似を使う。したがって,次の式が成り立つ。
2A→C のとき,v=k[A]2 だから,
nA→C のとき,v=k[A]n になる。
そこで,次のような反応を考える。
この反応の反応速度は次のような式になる。
では,次の可逆反応について考えてみよう。
右向きの正反応の反応速度をv1,左向きの逆反応の反応速度をv2とすると,v1,v2は次の式で与えられる。
| v1=k[A]a[B]b | | v2=k'[C]c[D]d | 化学平衡に達すると,v1=v2であるから,次の式が成り立つ。
約束事として平衡定数を次のように定義する。
| [C]c[D]d | | k | | | | ――――― | = | ― | = | K | | [A]a[B]b | | k' | | |
|
この係数K を平衡定数といいます。また,平衡時の物質の濃度間に成り立つ式の関係を「化学平衡の法則」といいます。この関係は1864年,ノルウェーのグルベルグとボーゲにより提唱されました。この関係は「質量作用の法則」ともいわれています。low of mass action を直訳しているのでしょう。mass を質量と考えたのですね。私も高校生時代に変な名前の法則だなと思った記憶があります。mass には,(一定のかたちのない)大きなかたまり,多数,多量,大部分,大半,大衆,庶民,大きさ,量,かさなどの意味があります。また,mass action には大衆行動という意味があります。
それでは,具体的にアンモニアの合成で考えてみましょう。
 |
 この章では,化学平衡について学びましょう。
この章では,化学平衡について学びましょう。