ボイルの法則
(気体の体積と圧力の関係を知ろう)
ボイルの法則について
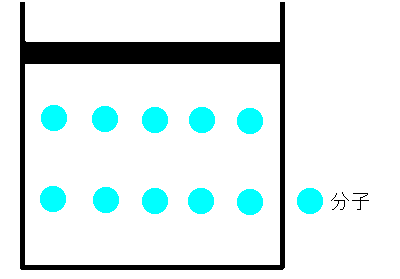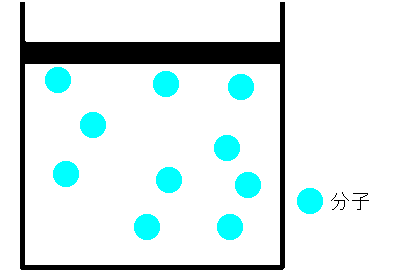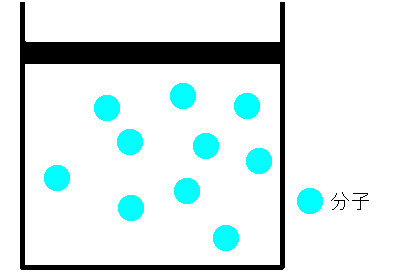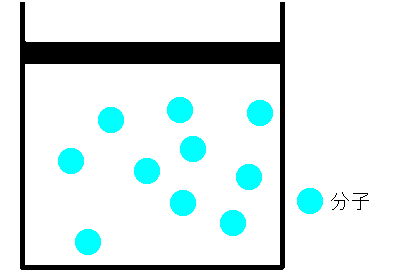
シリンダーの中に空気をいれ、栓をします。空気が漏れないように栓を押していくと、シリンダー内の空気の体積は小さくなります。これは、まるでバネのように押せば縮み、離すと元に戻るのです。どうしてでしょうか。ボイルは、空気は分子とすき間で構成されていて、押せばそのすき間が狭くなると考えました。そして、すき間が半分になれば分子の衝突回数も2倍になり、衝突によって圧力が大きくなると考えました。つまり、ボイルによるとこの時の気体の圧力と体積の間には反比例の関係があると結論付けました。これを、ボイルの法則といいます。
 |
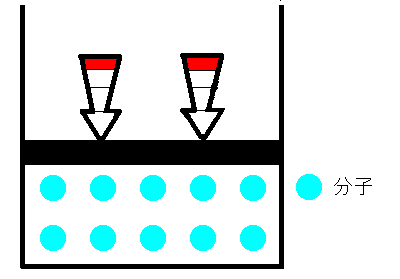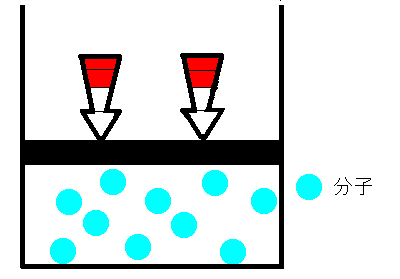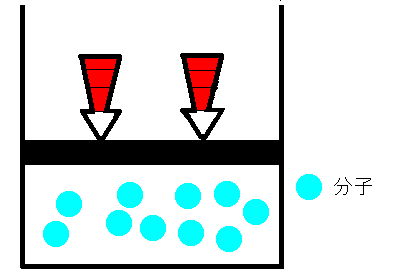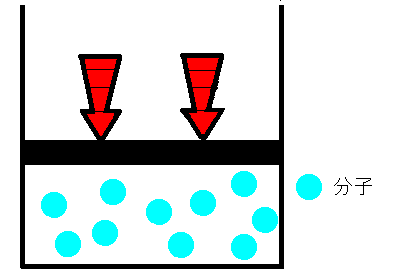 |
pV=a
(p:気体の圧力(Pa) V:体積 a:気体の量や温度に依存する定数)
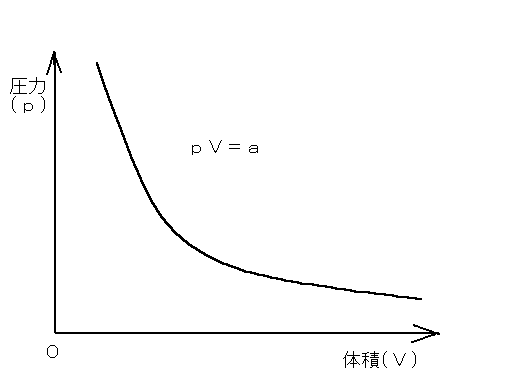
温度を一定に保って体積を変えると、気体の状態はpV=aの双曲線で表す明すことができます。
ここまで理解できたら、ボイル・シャルルの法則へGO
参考文献
大塚徳勝著:「そこが知りたい物理学」共立出版(株) 1999年
小暮陽三著:「ゼロから学ぶ熱力学」 講談社 2001年
川村 清著:「基礎物理学シリーズ 熱学」(株)東京教学社 1997年