ボイル・シャルルの法則
(ボイルの法則+シャルルの法則)
ボイル・シャルルの法則について
ボイルの法則とは、一定温度下での体積と圧力の関係でした。そして、シャルルの法則とは、一定圧力下での体積と温度の関係でした。つまり、体積は圧力と温度によって、変化します。そこで、ボイルの法則とシャルルの法則をあわせると、圧力と温度が同時に変化した時の関係を導くことができます。 一定量の気体の圧力(p)、温度(T)、体積(V)の関係は次のようにまとめることができます。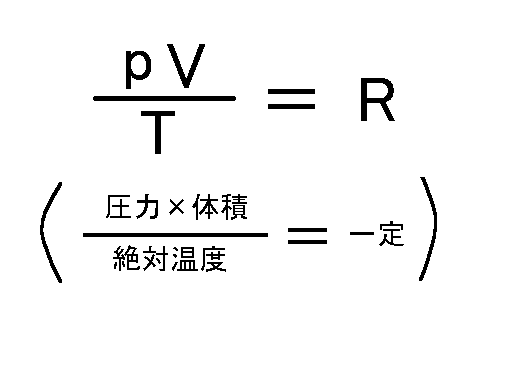
この式より、絶対温度Tが一定の時はボイルの法則に、圧力pが一定の時はシャルルの法則に等しいことが分かります。 そして、これをボイル・シャルルの法則といい、この法則に従う気体を理想気体といいます。理想と呼ぶのは、この法則が、あまりに温度が低かったり、圧力が高かったりすると成立しないためです。 また、この式から温度、圧力、体積が変化しても一定の値を示すことがわかります。そして、この値をRを気体定数といいます。気体定数は1モルあたりの値です。
1モルの気体は、アボガドロの法則によると、気体の種類に関係なく6.02×10の23乗個の分子で構成されていて、それは、0℃・1気圧の標準状態で22.4㍑の体積の中に含まれています。
それでは、気体定数を実際に計算してみましょう。
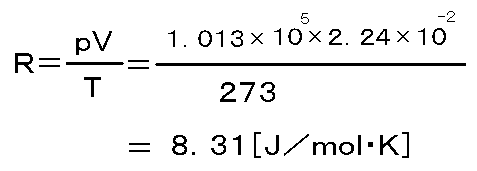
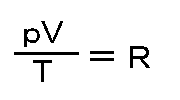
つまり、
pV=RT
これを1モルの気体の状態方程式といいます。また、気体の体積はモル数に比例しますので、nモルの気体については、次式のとおりで、これを理想気体の状態方程式といいます。
pV=nRT
参考文献
大塚徳勝著:「そこが知りたい物理学」共立出版(株) 1999年
小暮陽三著:「ゼロから学ぶ熱力学」 講談社 2001年
川村 清著:「基礎物理学シリーズ 熱学」(株)東京教学社 1997年