絶 対 温 度
(その原理を知ろう)
絶対温度について
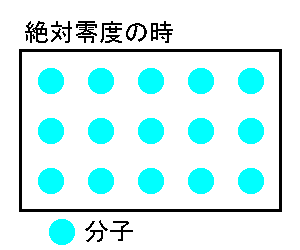
セルシウス温度(セ氏・℃)は、1気圧の状態で水の氷点(氷の融点)を0℃、沸点を100℃としました。そして、その間を100等分したものを1℃としました。もし、私たちが温度計を作って0℃と100℃の間を100等分するとしたら、定規で測って1℃づつ目盛りをつけていくでしょう。しかし、この方法は不正確なのです。なぜなら、水銀温度計やアルコール温度計は、細管中の液体の熱膨張を利用したものであるが、熱膨張率は温度によって違うのです。。 そこで、ケルビン(K)は、物質の種類に左右されない温度を定める為、理想気体の熱膨張を計算して、絶対温度を定めました。理想気体に近いのはAr(アルゴン)やHe(ヘリウム)です。 あらゆる物質が原子や分子で構成されているのは、ご承知のとおりですが、これら分子や原子はたえず運動をしています。そして、その運動は温度によって変化し、高温になるほど激しくなります。 温度を低下させていくと、理論上、分子や原子の運動が完全に停止する状態ができます。その温度を絶対零度といいます。分子や原子の運動が停止しますので、これより低い温度は存在しません。絶対零度はセ氏ではマイナス273.15℃です。ケルビンはこの温度を0Kと定めました。なお、温度に上限はありませんので、1万度や10万度といいた高温は存在します。 セ氏(℃)と絶対温度(K)の関係は次の通りです。
T(K)=t(℃)+273.15
 |
 |
 |
参考文献
小暮陽三著:「ゼロから学ぶ熱力学」 講談社 2001年
川村 清著:「基礎物理学シリーズ 熱学」(株)東京教学社 1997年